組換え抗体の開発——設計から発現まで
組換え抗体は、遺伝子工学的に作られた抗体とも呼ばれ、以下のプロセスを経て得られる抗体を指します:まず、DNA組換え技術を用いて、抗体の対応する遺伝子配列を必要に応じて改変・組換え、次にプラスミドに構築し、最後に構築したプラスミドを適切な宿主細胞にトランスフェクション/形質転換し、タンパク質異種発現技術により発現させます。
組換え抗体の開発には、抗体スクリーニング、配列最適化、抗体工学的改変、発現ベクター構築、機能検証などの複数のサブモジュールが含まれます。体系的なサービスプロセスを通じて、基礎科学研究、生物製品開発、前臨床検証などの様々なシナリオをサポートし、抗体取得の効率と品質を大幅に向上させます。
1. 抗体スクリーニングプラットフォームと戦略
プロジェクトの要件とサンプルソースに基づいて、抗体スクリーニングでは通常、以下の3つの技術プラットフォームが採用されます:
ファージディスプレイ技術:大規模なscFvやFab抗体ライブラリーの構築に適し、標的抗体の親和性成熟やエピトープスクリーニングに広く使用されています。
ハイブリドーマ技術:マウスなどの動物における免疫抗体の開発に適用され、スクリーニングとサブクローニングのための成熟したプラットフォームを備えています。
単一B細胞スクリーニング技術:フローサイトメトリーによるソーティングと単一細胞シーケンシング技術を通じて、天然の重鎖-軽鎖対合を持つヒトまたは動物由来の抗体を直接取得することができます。
2. 抗体配列設計と工学的最適化
組換え抗体開発の核心は抗体配列の工学的設計にあり、主に以下の側面が含まれます:
抗体のヒト化:マウスなどの非ヒト種由来の抗体については、CDR配列を保持し、フレームワーク配列を置換することで免疫原性を低下させることができます。
親和性向上:構造モデリングや部位特異的変異誘発を通じて変異体ライブラリーを構築し、次に2回目のスクリーニングを行うことで、より高い親和性を持つ抗体変異体を取得します。
構造構成の選択:アプリケーションの要件に応じて、全長IgG抗体、scFv、Fab、VHH単一ドメイン抗体を設計するか、さらに二重特異性抗体構造を構築します。
同時に、配列最適化では、凝集傾向、熱安定性、グリコシル化部位の保持などの様々なパラメーターを考慮し、後続の発現と機能検証のニーズを満たす必要があります。
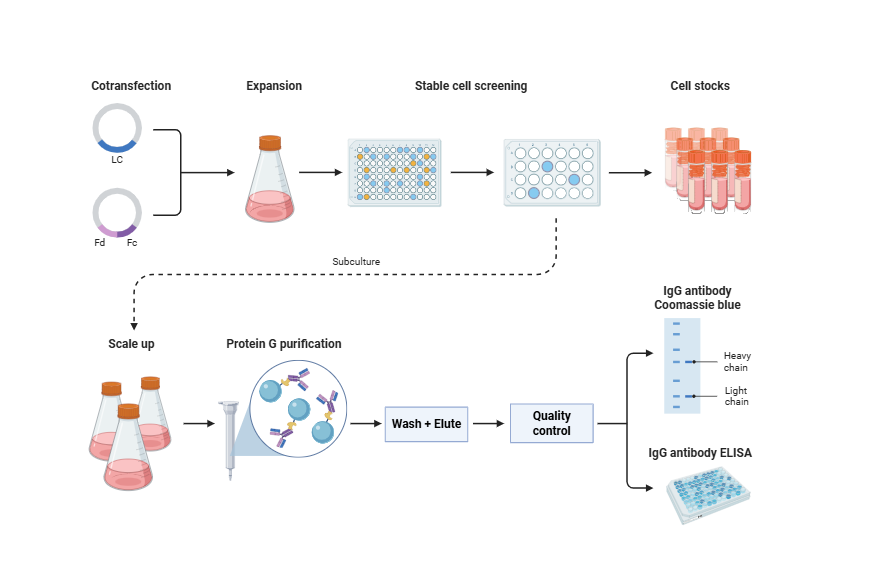
3. 発現システム構築と抗体生産
一般的な哺乳類発現システムには、CHO細胞システムとHEK293細胞システムが含まれます。
CHO細胞発現システムは、現在最も広く使用されている抗体発現プラットフォームです。長期的な安定発現、高レベルの分泌、工業的スケールアップ生産に適しており、GLPまたはGMP基準への移行をサポートします。
HEK293発現システムは、小規模な発現、迅速なスクリーニング、一過性トランスフェクション実験に適しており、初期および中期の抗体発現検証に適用されます。
発現ベクターの設計には、プロモーター(例:CMV、EF1α)、エンハンサーエレメント(例:WPRE)、シグナルペプチド配列、ターミネーターの選択などの要因を考慮し、コドン最適化を行う必要があります。構築された発現ベクターは、トランスフェクション、安定クローンスクリーニング、または一過性発現によって組換え抗体の発現を達成します。
4. 精製と機能検証
組換え抗体の生産後は、標準化された精製と品質評価プロセスが必要です。
抗体の精製には、タンパク質A/Gアフィニティークロマトグラフィーが初期精製に使用されます。必要に応じて、SECを補って凝集体を除去します。品質試験には、SDS-PAGE、SEC-HPLC、エンドトキシン検出、抗体濃度測定が含まれます。機能検証には、ELISA、WB、IHC、SPRまたはBLI親和性検出などの試験が含まれます。一部のプロジェクトでは、追加の細胞中和アッセイまたはFc媒介性機能解析(例:ADCC)も必要です。
よくある質問
Q1: 組換え抗体と従来の抗体の違いは何ですか?
A1: 組換え抗体は特定の遺伝子セットから生産されるため、生産が制御可能です。理論的には、任意の抗原を標的とする組換え抗体を構築することができます。一方、ハイブリドーマによって引き起こされる遺伝子欠失、遺伝子変異、細胞株のドリフトなどの問題を回避することができます。そのため、バッチ間の変動が非常に小さく、結果の再現性が高いです。組換え技術を使用すると、抗体工学によって抗体の特異性と感度をより容易に向上させることができます。ハイブリドーマおよび組換えクローニング段階では、所望のクローンを選択して最高品質の抗体をスクリーニングすることができます。
Q2: なぜほとんどの組換え抗体の発現にCHO細胞が使用されているのですか?
A2: CHO細胞発現システムは、優れたタンパク質の折りたたみとヒト化されたグリコシル化能力を持ち、高い発現レベルとともに、長期的な安定生産に適しています。さらに、すでに市場に出ている多数の承認された抗体医薬品によって、その安全性と実現可能性が検証されています。
Q3: 抗体のヒト化は必ず活性に影響を与えますか?
A3: 不適切なヒト化設計は結合能力に影響を与える可能性がありますが、構造モデリングと複数ラウンドの親和性最適化を通じて、免疫原性を低下させながら、元の機能を保持またはさらに強化することができます。
Q4: 抗体発現が失敗する一般的な原因は何ですか?
A4: 一般的な原因には、発現ベクターの構築ミス、コドン使用頻度の不一致、シグナルペプチド機能の欠損、細胞毒性を持つ発現タンパク質、抗体自身の配列中の異常な構造領域などがあります。
Q5: 組換え抗体の発現と精製は、組換えタンパク質のそれとどのような違いがありますか?
A5: これら2つのプロセスの基本的なロジックは同じです:どちらも遺伝子クローニングによって発現ベクターを構築し、宿主細胞で異種発現を達成し、次に標的タンパク質をその物理的、化学的、または生物学的特性に基づいて分離・精製します。ただし、鍵となるステップには大きな違いがあります。本質的に、組換え抗体は組換えタンパク質の特定のサブクラスです。
発現システムの選択に関しては、組換え抗体はCHOやHEK293細胞などの真核生物システムを優先します。これらは、その活性を確保するためにグリコシル化修飾を必要とします。これに対し、一般的な組換えタンパク質は、原核生物、真核生物、またはその他のシステムで柔軟に発現することができ、グリコシル化の義務はありません。
精製については、組換え抗体はまずタンパク質A/G/Lクロマトグラフィーを受けます。これは、抗体の定常領域の特異的結合を利用して、純度を90%以上に迅速に高めます。その後、イオン交換クロマトグラフィーや疎水性相互作用クロマトグラフィーなどの方法を使用して精密な精製を行います。一般的な組換えタンパク質の場合、精製方法(例:His-tag、GST-tagによるアフィニティークロマトグラフィー、イオン交換クロマトグラフィー、ゲルろ過クロマトグラフィーなど)は、タンパク質の特定の特性に基づいて選択されます。
組換えウサギモノクローナル抗体 EnkiLifeが発売する組換えウサギモノクローナル抗体は、7,000種以上の豊富な品揃えと多様な実験シナリオとの完全な互換性を活用し、科学研究のニーズに効率的な解決策を提供します。
従来のモノクローナル抗体と比較して、当社の組換えウサギモノクローナル抗体は遺伝子工学技術によって精密に構築されています。これにより、ハイブリドーマ技術に関連する潜在的なバッチ間変動を完全に回避するだけでなく、より高い特異性と親和性を実現し、非特異的結合による実験的干渉を効果的に低減します。同時に、安定した生産プロセスによってバッチ間で一貫した性能が保証され、実験結果がより信頼性の高いものになります。
現在、当社の組換えウサギモノクローナル抗体は、WB、ICC/IF、IP、IHCなどの主流の実験シナリオを完全にカバーしています。タンパク質の定性・定量分析、組織切片染色、タンパク質間相互作用研究など、正確にニーズを満たし、研究者が実験プロセスを効率的に進めるのを支援します。 組換えウサギモノクローナル抗体については、当社のウェブサイトをご覧ください。
 | フェリシア フェリシアはEnkiLifeの技術サポートスペシャリストで、抗体開発、最適化、ELISAアッセイの設計と応用に関する豊富な専門知識を持っています。彼女は、顧客が適切な抗体製品を選択し、ELISA実験プロトコルを最適化し、プロセスで遭遇する技術的課題を解決するのを支援することに専念し、それによってライフサイエンス研究プロジェクトの円滑な進行を支援しています。 |
